O perfil da resposta imunitária pode ser modulado pelo perfil sexual? Dados epidemiológicos apontam para uma suscetibilidade masculina persistente no desenvolvimento e gravidade da doença COVID-19, desde bebês a adultos (1,2,3 e 4). Os doentes do sexo masculino com COVID-19 são três vezes mais susceptíveis de requerer admissão em unidades de cuidados intensivos e têm maiores probabilidades de morte do que os doentes do sexo feminino (5). Esta vulnerabilidade masculina à infecção materna por SARS-CoV-2, foi identificada também no período perinatal (1-3). Estudos recentemente publicados na Science, sugerem um potencial para uma “vantagem placentária antiviral” feminina de base e, é consistente com o aumento estabelecido da vulnerabilidade do feto masculino a ataques intrauterino, incluindo infecções viral e bacteriana (6 e 7). Interessantemente, foi observado diferenças sexuais na imunidade inata em células e tecidos não placentários (8 e 9).
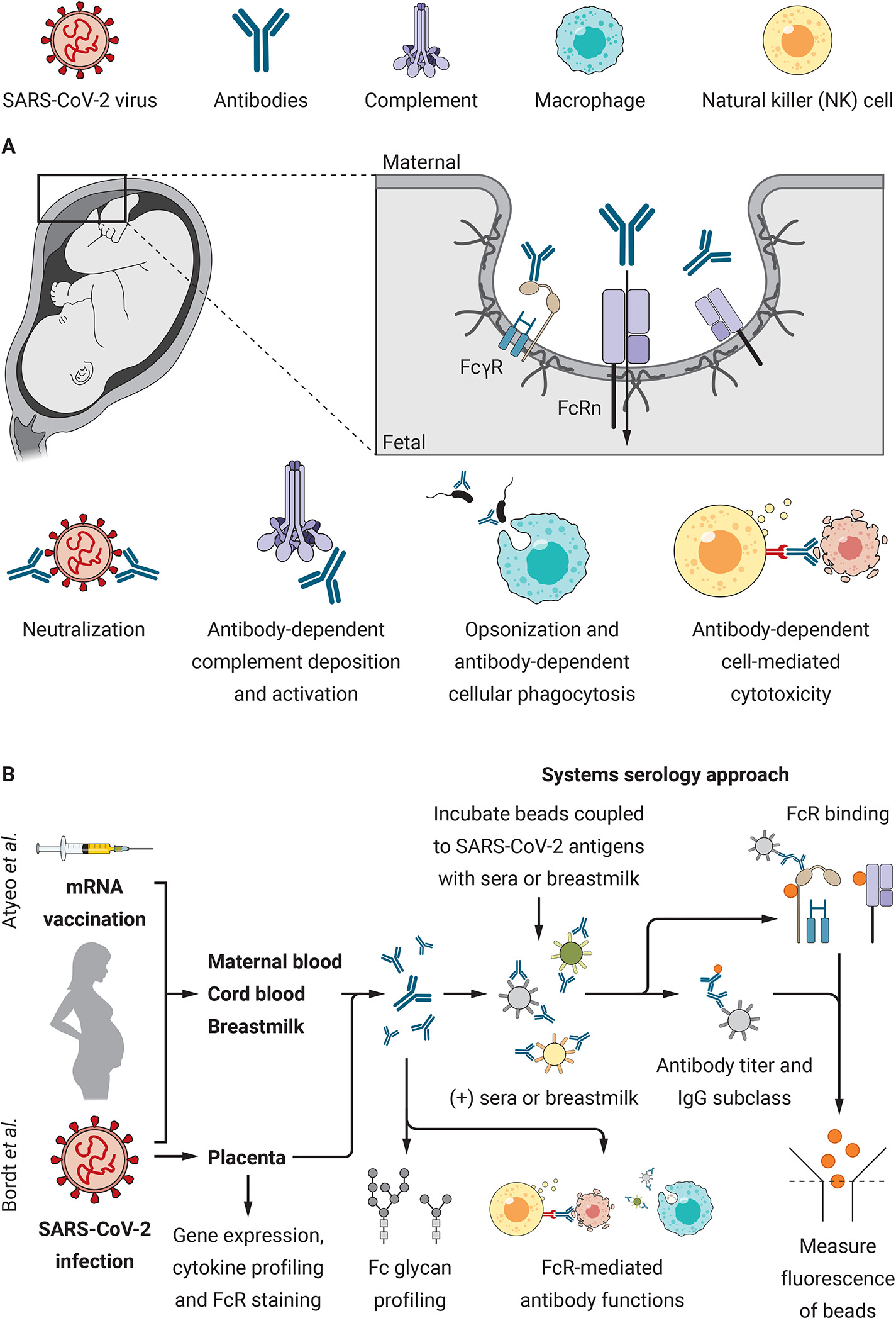
Os estudos de Atyeo et al (13) e Bordt et al (14), sobre as respostas imunitárias à vacinação e infecção do SARS-CoV-2 demonstram a natureza crítica da investigação das respostas imunitárias maternais e fetais durante a gravidez, um estado biológico altamente único. Estes resultados salientam a necessidade de futuros estudos que avaliem as diferenças das respostas imunitárias masculinas e femininas à placenta. As consequências a longo prazo da indução placentária associada à SARS-CoV-2, às respostas IFN Tipo I, II, e III para o desenvolvimento fetal e programação intraútero de resultados metabólicos e neurodesenvolvimento, precisam ser esclarecidas. Estes estudos têm implicações clínicas diretas para a pandemia da COVID-19 e para as futuras estratégias de vacinação materno-fetal, pois revelam que mulheres grávidas e lactantes têm respostas imunitárias distintas à imunização e à infecção natural.
Bibliografia
1) S. Godfred-Cato, B. Bryant, J. Leung, M. E. Oster, L. Conklin, J. Abrams, K. Roguski, B. Wallace, E. Prezzato, E. H. Koumans, E. H. Lee, A. Geevarughese, M. K. Lash, K. H. Reilly, W. P. Pulver, D. Thomas, K. A. Feder, K. K. Hsu, N. Plipat, G. Richardson, H. Reid, S. Lim, A. Schmitz, T. Pierce, S. Hrapcak, D. Datta, S. B. Morris, K. Clarke, E. Belay; California MIS-C Response Team, COVID-19-Associated Multisystem Inflammatory Syndrome in Children – United States, March-July 2020. MMWR Morb. Mortal. Wkly. Rep. 69, 1074–1080 (2020).
2) L. Kim, M. Whitaker, A. O’Halloran, A. Kambhampati, S. J. Chai, A. Reingold, I. Armistead, B. Kawasaki, J. Meek, K. Yousey-Hindes, E. J. Anderson, K. P. Openo, A. Weigel, P. Ryan, M. L. Monroe, K. Fox, S. Kim, R. Lynfield, E. Bye, S. Shrum Davis, C. Smelser, G. Barney, N. L. Spina, N. M. Bennett, C. B. Felsen, L. M. Billing, J. Shiltz, M. Sutton, N. West, H. K. Talbot, W. Schaffner, I. Risk, A. Price, L. Brammer, A. M. Fry, A. J. Hall, G. E. Langley, S. Garg; COVID-NET Surveillance Team, Hospitalization Rates and Characteristics of Children Aged <18 Years Hospitalized with Laboratory-Confirmed COVID-19 – COVID-NET, 14 States, March 1-July 25, 2020. MMWR Morb. Mortal. Wkly. Rep. 69, 1081–1088 (2020).
3) L. M. Yonker, A. M. Neilan, Y. Bartsch, A. B. Patel, J. Regan, P. Arya, E. Gootkind, G. Park, M. Hardcastle, A. St John, L. Appleman, M. L. Chiu, A. Fialkowski, D. De la Flor, R. Lima, E. A. Bordt, L. J. Yockey, P. D’Avino, S. Fischinger, J. E. Shui, P. H. Lerou, J. V. Bonventre, X. G. Yu, E. T. Ryan, I. V. Bassett, D. Irimia, A. G. Edlow, G. Alter, J. Z. Li, A. Fasano, Pediatric Severe Acute Respiratory Syndrome Coronavirus 2 (SARS-CoV-2): Clinical Presentation, Infectivity, and Immune Responses. J. Pediatr. 227, 45–52.e5 (2020).
4) C. M. Petrilli, S. A. Jones, J. Yang, H. Rajagopalan, L. O’Donnell, Y. Chernyak, K. A. Tobin, R. J. Cerfolio, F. Francois, L. I. Horwitz, Factors associated with hospital admission and critical illness among 5279 people with coronavirus disease 2019 in New York City: Prospective cohort study. BMJ 369, m1966 (2020).
5) H. Peckham, N. M. de Gruijter, C. Raine, A. Radziszewska, C. Ciurtin, L. R. Wedderburn, E. C. Rosser, K. Webb, C. T. Deakin, Male sex identified by global COVID-19 meta-analysis as a risk factor for death and ITU admission. Nat. Commun. 11, 6317 (2020).
6) Z. H. Aghai, S. S. Goudar, A. Patel, S. Saleem, S. M. Dhaded, A. Kavi, P. Lalakia, F. Naqvi, P. L. Hibberd, E. M. McClure, T. L. Nolen, P. Iyer, R. L. Goldenberg, R. J. Derman, Gender variations in neonatal and early infant mortality in India and Pakistan: A secondary analysis from the Global Network Maternal Newborn Health Registry. Reprod. Health 17 (Suppl 3), 178 (2020).
7) N. Turner, K. Danesh, K. Moran, The evolution of infant mortality inequality in the United States, 1960-2016. Sci. Adv. 6, eaba5908 (2020).
8) R. Pongou, Why is infant mortality higher in boys than in girls? A new hypothesis based on preconception environment and evidence from a large sample of twins. Demography 50, 421–444 (2013).
9) R. L. Goldenberg, W. W. Andrews, O. M. Faye-Petersen, A. R. Goepfert, S. P. Cliver, J. C. Hauth, The Alabama Preterm Birth Study: Intrauterine infection and placental histologic findings in preterm births of males and females less than 32 weeks. Am. J. Obstet. Gynecol. 195, 1533–1537 (2006).
10) A. Ghidini, C. M. Salafia, Gender differences of placental dysfunction in severe prematurity. BJOG 112, 140–144 (2005).
11) J. A. DiPietro, K. M. Voegtline, The gestational foundation of sex differences in development and vulnerability. Neuroscience 342, 4–20 (2017).
12) S. L. Klein, K. L. Flanagan, Sex differences in immune responses. Nat. Rev. Immunol. 16, 626–638 (2016).
13) C. Atyeo, E. A. DeRiso, C. Davis, E. A. Bordt, R. M. DeGuzman, L. L. Shook, L. M. Yonker, A. Fasano, B. Akinwunmi, D. A. Lauffenburger, M. A. Elovitz, K. J. Gray, A. G. Edlow, G. Alter, COVID-19 mRNA vaccines drive differential Fc-functional profiles in pregnant, lactating, and non-pregnant women. Sci. Transl. Med. 13, eabi8631 (2021).
14) E. A. Bordt, L. L. Shook, C. Atyeo, K. M. Pullen, R. M. De Guzman, M.-C. Meinsohn, M. Chauvin, S. Fischinger, L. J. Yockey, K. James, R. Lima, L. M. Yonker, A. Fasano, S. Brigida, L. M. Bebell, D. J. Roberts, D. Pépin, J. R. Huh, S. D. Bilbo, J. Z. Li, A. Kaimal, D. Schust, K. J. Gray, D. Lauffenburger, G. Alter, A. G. Edlow, Sexually dimorphic placental responses to maternal SARS-CoV-2 infection. Sci. Transl. Med. 13, eabi7428 (2021).